和譽-B(02256):ABSK021 TGCT臨床三期完成首例美國病人給藥
 (資料圖片)
(資料圖片)
智通財經APP訊,和譽-B(02256)發布公告,2023年8月2日,上海和譽生物醫藥科技有限公司(和譽醫藥)已完成“一項評估ABSK021在腱鞘巨細胞瘤患者中有效性和安全性的隨機、雙盲、安慰劑對照、多中心III期臨床研究(方案編號:ABSK021-301)”的美國首例患者給藥。此前,Pimicotinib已在今年4月完成中國首例患者給藥。
Pimicotinib是和譽醫藥獨立自主研發的一款全新口服、高選擇性、高活性CSF-1R 小分子抑制劑。研究表明,阻斷CSF1/CSF1R信號通路可調節和改變巨噬細胞功能,在多種巨噬細胞相關疾病中發揮作用。基于在臨床Ib期展現出的77.4%客觀緩解率(ORR)等優異研究結果,Pimicotinib分別于2022年7月20日和2023年1月 30日以及2023年6月7日被國家藥品監督管理局藥品審評中心(CDE)和美國食品藥品監督管理局(FDA)以及歐洲藥品管理局(EMA)認定為突破性治療藥物和優先藥物,用于治療不可手術的腱鞘巨細胞瘤(TGCT)。
TGCT是一種局部浸潤性軟組織腫瘤,最常見于關節滑膜、滑囊或腱鞘,臨床表現為受累關節疼痛和僵硬、腫脹、出血性關節積液、關節周圍糜爛、軟骨退化和繼發性骨關節炎,嚴重影響患者生活質量。目前,中國和歐洲尚無針對該疾病的治療藥物,美國僅有一款藥物獲批上市,但由于其潛在肝毒性,患者需通過風險評估與緩解策略(REMS)計劃這一受限制的程序獲得,中美歐區域TGCT患者的臨床治療需求尚未被滿足。
Pimicotinib是中國第一個自主研發并進入全球臨床III期的高選擇性CSF-1R抑制劑。此項研究也是TGCT疾病領域首個在中國、美國和歐洲同步開展的全球III期研究,計劃入組約100例受試者,包括30家中國中心在內的全球約50家中心將參與該項臨床研究。
ABSK021-301是一項評估ABSK021在TGCT患者中的有效性和安全性的隨機、雙盲、安慰劑對照的全球多中心III期臨床研究。試驗包括Part 1和Part 2兩個階段。在Part 1中,符合條件的受試者將被隨機分配至ABSK021治療組或匹配的安慰劑組,并在雙盲條件下接受50mg QD的ABSK021或匹配的安慰劑治療,每28天為一個周期,直到完成Part 1部份的研究。完成Part 1研究的受試者將有資格繼續參與 Part 2的研究。Part 2研究是一個開放標簽的治療階段,進入本階段的所有受試者都將接受50mg QD開放標簽的ABSK021治療,直至完成24周的給藥或退出研究。研究計劃入組約100例受試者,主要終點是基于盲態的獨立評審委員會(BIRC)評估的25周ORR。
關鍵詞:
-
 和譽-B(02256):ABSK021 TGCT臨床三期完成首例美國病人給藥 智通財經APP訊,和譽-B(02256)發布公告,2023年8月2日,上海和譽生物醫
和譽-B(02256):ABSK021 TGCT臨床三期完成首例美國病人給藥 智通財經APP訊,和譽-B(02256)發布公告,2023年8月2日,上海和譽生物醫 -
 恒指牛熊街貨比(63:37)︱1月12日 截至1月12日,恒指最新的牛熊街貨比例為63:37。法興恒指牛熊證街貨分布
恒指牛熊街貨比(63:37)︱1月12日 截至1月12日,恒指最新的牛熊街貨比例為63:37。法興恒指牛熊證街貨分布 -
 伊戈爾:截至2023年7月31日,公司股東總戶數為44,309戶 伊戈爾(002922)08月01日在投資者關系平臺上答復了投資者關心的問題。投
伊戈爾:截至2023年7月31日,公司股東總戶數為44,309戶 伊戈爾(002922)08月01日在投資者關系平臺上答復了投資者關心的問題。投 -
 安必平:杭州睿泓投資合伙企業(有限合伙)因違規交易被證監會出具警示函 8月2日安必平公開信息顯示,杭州睿泓投資合伙企業(有限合伙)、杭州高特
安必平:杭州睿泓投資合伙企業(有限合伙)因違規交易被證監會出具警示函 8月2日安必平公開信息顯示,杭州睿泓投資合伙企業(有限合伙)、杭州高特 -
 圖解惠城環保中報:第二季度單季凈利潤同比增6467.64% 惠城環保2023中報顯示,公司主營收入5 06億元,同比上升251 11%;歸母
圖解惠城環保中報:第二季度單季凈利潤同比增6467.64% 惠城環保2023中報顯示,公司主營收入5 06億元,同比上升251 11%;歸母 -
 美股異動 | 瑞幸咖啡(LKNCY.US)漲超5.8% Q2總收入同比增88% 8月1日(周二),瑞幸咖啡(LKNCY US)股價走高,截至發稿,該股漲超5 8%,
美股異動 | 瑞幸咖啡(LKNCY.US)漲超5.8% Q2總收入同比增88% 8月1日(周二),瑞幸咖啡(LKNCY US)股價走高,截至發稿,該股漲超5 8%,
-
 和譽-B(02256):ABSK021 TGCT臨床三期完成首例美國病人給藥 智通財經APP訊,和譽-B(02256)發布公告,2023年8月2日,上海和譽生物醫
和譽-B(02256):ABSK021 TGCT臨床三期完成首例美國病人給藥 智通財經APP訊,和譽-B(02256)發布公告,2023年8月2日,上海和譽生物醫 -
 恒指牛熊街貨比(63:37)︱1月12日 截至1月12日,恒指最新的牛熊街貨比例為63:37。法興恒指牛熊證街貨分布
恒指牛熊街貨比(63:37)︱1月12日 截至1月12日,恒指最新的牛熊街貨比例為63:37。法興恒指牛熊證街貨分布 -
 一月一回眸 | 2023年的第七個月,一個又一個好消息紛至沓來,城市發展的美好畫卷... 隨著主塔塔冠順利吊裝完成,滹沱河特大橋工程將加快推進主橋合龍,全面
一月一回眸 | 2023年的第七個月,一個又一個好消息紛至沓來,城市發展的美好畫卷... 隨著主塔塔冠順利吊裝完成,滹沱河特大橋工程將加快推進主橋合龍,全面 -
 美媒列出湖人2023-24賽季15人陣容,湖人是如何得到這15人的 在2023年休賽季,湖人給他送上了一份4年5300萬美元的續約合同,這也是
美媒列出湖人2023-24賽季15人陣容,湖人是如何得到這15人的 在2023年休賽季,湖人給他送上了一份4年5300萬美元的續約合同,這也是 -
 駕駛證 c1增駕b1 需要什么條件和手續(駕駛證 C1增駕B1 需要什么條件) 駕駛證c1增駕b1需要什么條件和手續,駕駛證C1增駕B1需要什么條件這個很
駕駛證 c1增駕b1 需要什么條件和手續(駕駛證 C1增駕B1 需要什么條件) 駕駛證c1增駕b1需要什么條件和手續,駕駛證C1增駕B1需要什么條件這個很 -
 伊戈爾:截至2023年7月31日,公司股東總戶數為44,309戶 伊戈爾(002922)08月01日在投資者關系平臺上答復了投資者關心的問題。投
伊戈爾:截至2023年7月31日,公司股東總戶數為44,309戶 伊戈爾(002922)08月01日在投資者關系平臺上答復了投資者關心的問題。投 -
 安必平:杭州睿泓投資合伙企業(有限合伙)因違規交易被證監會出具警示函 8月2日安必平公開信息顯示,杭州睿泓投資合伙企業(有限合伙)、杭州高特
安必平:杭州睿泓投資合伙企業(有限合伙)因違規交易被證監會出具警示函 8月2日安必平公開信息顯示,杭州睿泓投資合伙企業(有限合伙)、杭州高特 -
 圖解惠城環保中報:第二季度單季凈利潤同比增6467.64% 惠城環保2023中報顯示,公司主營收入5 06億元,同比上升251 11%;歸母
圖解惠城環保中報:第二季度單季凈利潤同比增6467.64% 惠城環保2023中報顯示,公司主營收入5 06億元,同比上升251 11%;歸母 -
 科大訊飛:訊飛星火APP正在升級優化 蘋果商店尚在更新中 科大訊飛(002230)在互動平臺回應蘋果應用商店下架星火大模型APP提問時
科大訊飛:訊飛星火APP正在升級優化 蘋果商店尚在更新中 科大訊飛(002230)在互動平臺回應蘋果應用商店下架星火大模型APP提問時 -
 OPPO 官博更換新版 LOGO!綠底變黑底 不能叫綠廠了? 來源:手機中國?OPPO的LOGO無論怎么變,經典的綠底基本都得到了保留。
OPPO 官博更換新版 LOGO!綠底變黑底 不能叫綠廠了? 來源:手機中國?OPPO的LOGO無論怎么變,經典的綠底基本都得到了保留。 -
 蘋果史上第二張支票拍賣,喬布斯和沃茲簽名 8月1日消息,近日,一批罕見的蘋果公司收藏品在RR拍賣網站上開拍,其中
蘋果史上第二張支票拍賣,喬布斯和沃茲簽名 8月1日消息,近日,一批罕見的蘋果公司收藏品在RR拍賣網站上開拍,其中 -
 剛剛通報:“全部平安”! 8月1日晚北京鐵路官方微博通報受暴雨影響中途停留的K396次、Z180次、K1
剛剛通報:“全部平安”! 8月1日晚北京鐵路官方微博通報受暴雨影響中途停留的K396次、Z180次、K1 -
 一壺漂泊浪跡天涯難入喉下一句(一壺漂泊浪跡天涯難入喉) 大家好,小福來為大家解答以上的問題。一壺漂泊浪跡天涯難入喉下一句,
一壺漂泊浪跡天涯難入喉下一句(一壺漂泊浪跡天涯難入喉) 大家好,小福來為大家解答以上的問題。一壺漂泊浪跡天涯難入喉下一句, -
 迪馬:國米可能2500萬+500萬歐拿下斯卡馬卡,羅馬沒有報價跡象 迪馬:國米可能2500萬+500萬歐拿下斯卡馬卡,羅馬沒有報價跡象直播吧8
迪馬:國米可能2500萬+500萬歐拿下斯卡馬卡,羅馬沒有報價跡象 迪馬:國米可能2500萬+500萬歐拿下斯卡馬卡,羅馬沒有報價跡象直播吧8 -
 安德的游戲:傀儡的影子(關于安德的游戲:傀儡的影子簡述) ,你們好,今天0471房產來聊聊一篇德的游戲:傀儡的影子,德的游戲:傀
安德的游戲:傀儡的影子(關于安德的游戲:傀儡的影子簡述) ,你們好,今天0471房產來聊聊一篇德的游戲:傀儡的影子,德的游戲:傀 -
 帶魚鱗需要刮掉嗎 帶魚鱗的作用) hello大家好,我是城鄉經濟網小晟來為大家解答以上問題,帶魚鱗需要刮
帶魚鱗需要刮掉嗎 帶魚鱗的作用) hello大家好,我是城鄉經濟網小晟來為大家解答以上問題,帶魚鱗需要刮 -
 美股異動 | 瑞幸咖啡(LKNCY.US)漲超5.8% Q2總收入同比增88% 8月1日(周二),瑞幸咖啡(LKNCY US)股價走高,截至發稿,該股漲超5 8%,
美股異動 | 瑞幸咖啡(LKNCY.US)漲超5.8% Q2總收入同比增88% 8月1日(周二),瑞幸咖啡(LKNCY US)股價走高,截至發稿,該股漲超5 8%, -
 雙槍科技(001211.SZ):特定股東科發海鼎、科發創投擬減持不超1.67%股份 格隆匯8月1日丨雙槍科技(001211 SZ)公布,公司于近日收到公司特定股東科
雙槍科技(001211.SZ):特定股東科發海鼎、科發創投擬減持不超1.67%股份 格隆匯8月1日丨雙槍科技(001211 SZ)公布,公司于近日收到公司特定股東科 -
 美股異動 | 和黃醫藥(HCM.US)漲超7% 今年上半年收入同比增長163.74% 8月1日(周二),和黃醫藥(HCM US)股價走高,截至發稿,該股漲超7%,報15
美股異動 | 和黃醫藥(HCM.US)漲超7% 今年上半年收入同比增長163.74% 8月1日(周二),和黃醫藥(HCM US)股價走高,截至發稿,該股漲超7%,報15 -
 美股異動 | 白銀股集體下跌 First Majestic銀礦(AG.US)跌超4% 8月1日(周二),現貨白銀日內再度跌超2 00%,現報24 25美元 盎司。美股
美股異動 | 白銀股集體下跌 First Majestic銀礦(AG.US)跌超4% 8月1日(周二),現貨白銀日內再度跌超2 00%,現報24 25美元 盎司。美股 -
 通達集團(00698)附屬通達創智合共認購2.65億元理財產品 智通財經APP訊,通達集團(00698)公布,于2023年7月14日及2023年8月1日
通達集團(00698)附屬通達創智合共認購2.65億元理財產品 智通財經APP訊,通達集團(00698)公布,于2023年7月14日及2023年8月1日 -
 交通運輸部:全力做好交通運輸防汛搶險救災各項工作 據交通運輸部消息,8月1日,交通運輸部召開調度會議部署全力做好交通運
交通運輸部:全力做好交通運輸防汛搶險救災各項工作 據交通運輸部消息,8月1日,交通運輸部召開調度會議部署全力做好交通運 -
 咸亨國際董監高隋琳2023年07月21日減持278,000股,套現355.01萬元 咸亨國際(605056)董監高隋琳2023年07月21日減持278,000股,每股成交
咸亨國際董監高隋琳2023年07月21日減持278,000股,套現355.01萬元 咸亨國際(605056)董監高隋琳2023年07月21日減持278,000股,每股成交 -
 我們的世界真美好歌詞 世界真美好的歌詞 1、第二套全國幼兒廣播體操>大公雞喔喔叫,外面的世界多美妙;小朋友們
我們的世界真美好歌詞 世界真美好的歌詞 1、第二套全國幼兒廣播體操>大公雞喔喔叫,外面的世界多美妙;小朋友們 -
 智云股份(300097.SZ)大股東譚永良擬向宋長江協議轉讓1450萬股 智通財經APP訊,智云股份(300097)(300097 SZ)公告,公司持股5%以上股東
智云股份(300097.SZ)大股東譚永良擬向宋長江協議轉讓1450萬股 智通財經APP訊,智云股份(300097)(300097 SZ)公告,公司持股5%以上股東 -
 金侖控股有限公司(01783.HK)完成配售1.47億股凈籌約3579萬港元 將用于電動車充... 格隆匯8月1日丨金侖控股有限公司(01783 HK)宣布,由于認購協議所載之所
金侖控股有限公司(01783.HK)完成配售1.47億股凈籌約3579萬港元 將用于電動車充... 格隆匯8月1日丨金侖控股有限公司(01783 HK)宣布,由于認購協議所載之所 -
 華潤三九:7月24日投資者關系活動記錄,Athena Capital、keystone Capital等多家機構參與 2023年8月1日華潤三九(000999)(000999)發布公告稱公司于2023年7月24
華潤三九:7月24日投資者關系活動記錄,Athena Capital、keystone Capital等多家機構參與 2023年8月1日華潤三九(000999)(000999)發布公告稱公司于2023年7月24 -
 腦洞科技(02203)購入1.5萬股Shopify股份 智通財經APP訊,腦洞科技(02203)發布公告,于2023年7月31日,公司于公
腦洞科技(02203)購入1.5萬股Shopify股份 智通財經APP訊,腦洞科技(02203)發布公告,于2023年7月31日,公司于公 -
 中證國際(00943.HK)擬發行21.03億股以債務資本化 格隆匯8月1日丨中證國際(00943 HK)公告,于2023年8月1日,公司與債權人
中證國際(00943.HK)擬發行21.03億股以債務資本化 格隆匯8月1日丨中證國際(00943 HK)公告,于2023年8月1日,公司與債權人 -
 從五糧液和老窖去庫存學到的 $東阿阿膠(SZ000423)$五糧液老窖阿膠第一階段:廠家發不出去貨的直接辦
從五糧液和老窖去庫存學到的 $東阿阿膠(SZ000423)$五糧液老窖阿膠第一階段:廠家發不出去貨的直接辦
熱門資訊
-
 行政拘留!以虛假證明、惡意投訴騙取關懷,招行信用卡堅決拒絕 近期,全國多地金融監管、公安、市...
行政拘留!以虛假證明、惡意投訴騙取關懷,招行信用卡堅決拒絕 近期,全國多地金融監管、公安、市... -
 58汽車聯合J.D. Power發布《中國汽車保值率風云榜》:中國品牌多點開花黑馬頻現 保值率是汽車品牌溢價與產品力的重...
58汽車聯合J.D. Power發布《中國汽車保值率風云榜》:中國品牌多點開花黑馬頻現 保值率是汽車品牌溢價與產品力的重... -
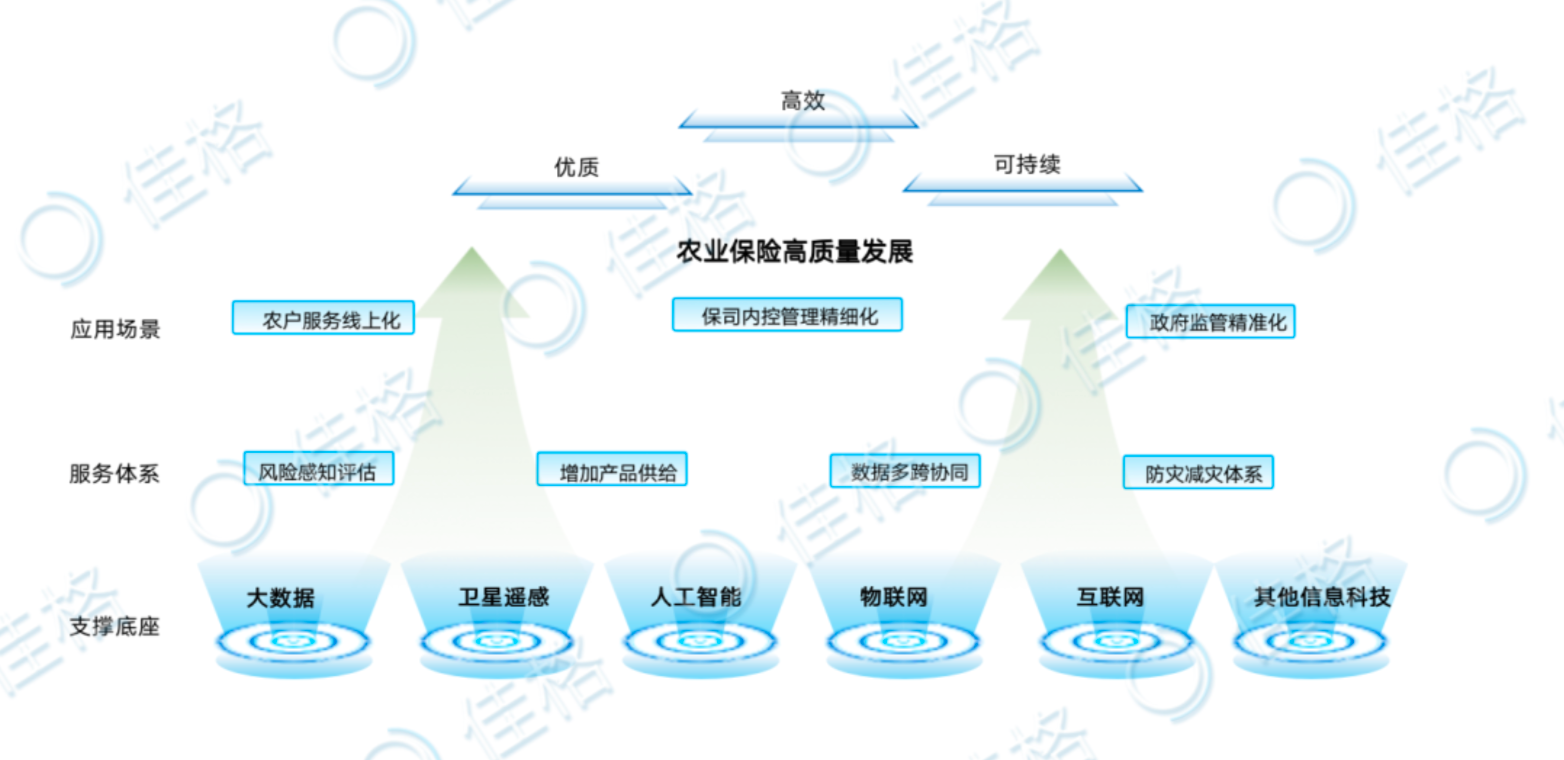 佳格天地與河北征信、秦皇島獨角獸達成戰略合作,協同推進農業金融數字化轉型 近期,佳格天地與河北省征信有限公...
佳格天地與河北征信、秦皇島獨角獸達成戰略合作,協同推進農業金融數字化轉型 近期,佳格天地與河北省征信有限公... -
 大樹云“彩云郵差”:關愛山區女孩健康成長的使者 2023年,大樹云集團開展了一系列幫...
大樹云“彩云郵差”:關愛山區女孩健康成長的使者 2023年,大樹云集團開展了一系列幫...
文章排行
圖片新聞
-
 國慶假期懷柔北部山區的紅葉進入最佳觀賞期 吸引游客前來賞秋景 國慶假期,懷柔北部山區的紅葉進入...
國慶假期懷柔北部山區的紅葉進入最佳觀賞期 吸引游客前來賞秋景 國慶假期,懷柔北部山區的紅葉進入... -
 重磅!四川省科創貸款較年初新增620.35億元 同比增長21.22% 記者日前從中國人民銀行成都分行獲...
重磅!四川省科創貸款較年初新增620.35億元 同比增長21.22% 記者日前從中國人民銀行成都分行獲... -
 252項“全程網辦”!川渝兩地企業登記檔案實現跨區域互查 8月30日,記者從省大數據中心獲悉...
252項“全程網辦”!川渝兩地企業登記檔案實現跨區域互查 8月30日,記者從省大數據中心獲悉... -
 2022年中國國際服務貿易交易會在京舉辦 四川參展企業數量創新高 8月31日至9月5日,主題為服務合作...
2022年中國國際服務貿易交易會在京舉辦 四川參展企業數量創新高 8月31日至9月5日,主題為服務合作...